
Az alábbiakban az Ökológiai Kutatóközpont, Balatoni Limnológiai Intézet, NAP ADAPTÁCIÓS NEUROETOLÓGIAI KUTATÓCSOPORT „Humán eredetű szennyezőanyagok a Balatonban II. - Gyógyszermaradványok okozta lehetséges kockázatok a kockázatbecslési módszerek gyengeségeinek tükrében” című írását közöljük. A szerzők: Molnár Éva, Maász Gábor és Pirger Zsolt.
A környezetünket szennyező szintetikus kémiai anyagok, ide értve az emberi eredetű gyógyszerhatóanyag maradványokat (xenobiotikumokat) is, kockázatot jelenthetnek az ökoszisztémára. Azonban, az adott terület élővilágát érintő valós kockázat nagyságának megállapítása komoly kihívást jelent a kutatók számára. A környezeti kockázat meghatározására egyfajta becslési módszer alkalmazható, amely az adott hatóanyag mért környezeti koncentrációját, illetve a biológiai szervezetek hatóanyagra vonatkozó érzékenységét veszi figyelembe. Emellett, befolyásoló tényező lehet még a hatás időtartama, a kontamináció (expozíció) módja és a biológiai hozzáférhetőség mértéke is. A kockázatbecslés eredményének bizonytalansága a rendelkezésre álló ökotoxikológiai adatok függvénye, ennélfogva az is egy kulcsfontosságú tényező.

Az adott ökotoxikológiai adat származhat egy élő szervezeten, vagy akár populáción végzett valós kísérlet eredményéből, vagy olyan modellszámításból (pl. Ecological Structure Activity Relationships – ECOSAR adatbázis), amely a szóban forgó hatóanyag fizika-kémiai jellemzői alapján következtet a várható toxikusságra. Fontos megjegyezni azonban, hogy ha kísérleti és modell alapú adatokat is ismerünk, és célunk a valós kockázat nagyságának meghatározása, akkor a becsléshez a kísérletesen kimért eredményeket kell felhasználni a modell alapúak helyett, mivel a kísérleti teszteredményeket nagyobb evidenciájúnak tekintjük. Ugyanakkor, a kockázatbecslés során a laboratóriumi mérési eredmények között is létezik prioritási sorrend, így például a krónikus (azaz a hosszú időtávon végzett; pl. 21, vagy 42 nap) kísérletek eredményei előnyt élveznek az akut (rövid időtartam alatt végzett; pár órás vagy legfeljebb 1-2 napos) teszteredményekkel szemben.
A kísérletek során (az alkalmazott teszt szervezettől függően) a mérhető vizsgálati változók között szerepelhet például, a szívritmus, a szaporodási képesség, a táplálkozási és mozgási aktivitás, a növekedési ütem, az agresszió, a regeneráció, bizonyos marker fehérjék mennyisége a szervezetben, vagy egyes mikroorganizmusok esetében akár még a fénykibocsátás is. A teszt állatot és a választott vizsgálati végpontot a különböző gyógyszerhatóanyagok eltérő hatásmechanizmusához igazítják. A gyakorlat szerint ökotoxikológiai kísérleteket leggyakrabban algákon, ágascsápú rákokon (Cladocera fajok, pl. nagy vízibolha [Daphnia magna]) és halakon végeznek, azonban minél tagoltabb a táplálékpiramis (trofitás szintek; pl. növények, növényevők, ragadozók), és minél több fajra vonatkozóan ismerünk teszteredményeket, a kockázatbecslés annál pontosabb képet ad a reális helyzetről.
Azonban az alapos ökológiai kockázatbecslés megvalósítása gyakran akadályokba ütközik. Például, számos hatóanyagra nem áll rendelkezésre elegendő és megbízható kísérletes ökotoxikológiai adat, vagy éppen azzal az esettel találkozunk, hogy többféle, egymásnak akár ellent is mondó adatot találunk, ami annak köszönhető, hogy a különböző tanulmányokban más és más mérési körülmények között zajlanak a vizsgálatok és így eltérő eredmények születhetnek. Ez utóbbi eset kezelésére már létezik megbízható szoftveres megoldás (pl. Chemical Aquatic Fate and Effects – CAFE adatbázis).
Mindemellett, fontos azt is megjegyezni, hogy az egyes szennyező vegyületek jellemzően nem egyedüli hatóanyagként fordulnak elő a környezetben, hanem úgynevezett „koktélt” alkotnak, melynek alkotóelemei egymás toxikus hatását képesek erősíteni (szinergista hatás), vagy gyengíteni (antagonista hatás). Ezekről a különböző „hatóanyag koktélok” által okozott hatásokról és kockázatokról alig-alig találunk kísérletes példát a tudományos szakirodalomban. Továbbá, mint említettük már, a környezeti kockázatbecslés a környezeti koncentrációktól függő érték, amely a számos befolyásoló tényezőnek (pl. gyógyszer fogyasztási szokások, népességeloszlás, turisztikai hatások, időjárás, stb.) köszönhetően folyamatosan változik (lásd előző írásunkban - Humán eredetű szennyezőanyagok a Balatonban I), azaz az ökoszisztémát érő stressz hatás is napról napra módosul.
Az említett nehézségeket megfelelően kezelve, a laborban elvégzett ökotoxikológiai vizsgálatok eredményeiből számos fontos és hasznos információ származtatható. Így például akut tesztek esetében meghatározható az EC50 (Effective Concentration), illetve az LC50 (Lethal Concentration) érték, melyek azt a koncentrációt mutatják kísérletes körülmények között, ahol a vizsgált populáció 50%-ára fejtett ki a kezelés valamilyen hatást, vagy okozott pusztulást. A krónikus kezelések esetében definiálható az ún. NOEC (No Observed Effective Concentration) érték, amely azt a legmagasabb koncentrációt fejezi ki, amely megfigyelhető változást még nem váltott ki a teszt szervezetben a kísérlet során. Az adott vegyületre és tesztszervezetre vonatkozó EC50, LC50 és/vagy NOEC értékek ismeretében, egy becslési bizonytalansági osztószám (AF–Assesment Factor) bevonásával, kiszámítható egy úgynevezett becsült hatástalan koncentráció (PNEC–Predicted No Effect Concentration) érték, ami az adott hatóanyag azon szintjét jelöli, amely az élővilágra feltehetőleg még éppen nem fejt ki hatást. Ha a vízmintában mért hatóanyag környezeti koncentrációját (MEC–Measured Environmental Concentration) az előbb említett PNEC értékhez viszonyítjuk, akkor megkapjuk RQ kockázati hányadost (Risk Quotient), melynek nagysága szerint a kockázat kategóriákba sorolható (1. táblázat).
![1. táblázat: A kockázati hányados (RQ) értékelése (ahol RQ=MEC/PNEC és PNEC=az ökotoxikológiai adat[EC50, LC50, vagy NOEC]/AF )*](download/d/fe/92000/B4.png)
*A kockázatbecsléshez a rendelkezésre álló ökotoxikológiai adatokból a fentebb leírt iránymutatások mellett, jellemzően a legrosszabb forgatókönyv szerinti verziót vesszük figyelembe. Azaz, például, ha a NOEC értéke több trofikus szinten is ismert, akkor a legkisebbet választjuk ki, és osztjuk el AF-el. AF jellemzően 1 és 1000 közé eső szám, mely nagysága az ismert ökotoxikológiai adatok függvénye. Például, ha csak egy trofikus szintre és fajra vonatkozó akut kísérleti adat ismert, akkor AF=1000, azonban ha már 3 trofikus szinten is rendelkezésünkre áll krónikus tesztből származó NOEC adat, akkor az AF=10.
Előző cikkünkben, a Balaton vizében (mintavételi helyek: Szigliget, Révfülöp, Balatonlelle, Tihany-Sajkod, Zamárdi, Siófok) 2017. június és 2018. október közötti időszakban kimutatott gyógyszerhatóanyag koncentrációk szezonális változásáról volt szó. Jelenlegi írásunkban ugyanazon mért koncentráció (MEC) adatokat felhasználva mutatjuk be a környezeti kockázatbecslés eredményét, a legrosszabb forgatókönyv szerinti verziót feltételezve (ez esetünkben azt jelenti, hogy az adott hatóanyagra és mérési időszakra nézve a 6 mintavételi helyen mért MEC közül a maximumokat vettük alapul a számításainkhoz). A Balatonban az általunk kimutatott 43 gyógyszerhatóanyag közül sajnálatos módon csak 16 db-ra található elegendő és hiteles kísérletesen kimért ökotoxikológiai adat a kockázatbecslés elvégzéséhez (Molnar et al., 2020). Az 1. ábra logaritmikus skálán szemlélteti a 16 hatóanyag kockázati hányadosának változását a mintavételi időpontok függvényében.
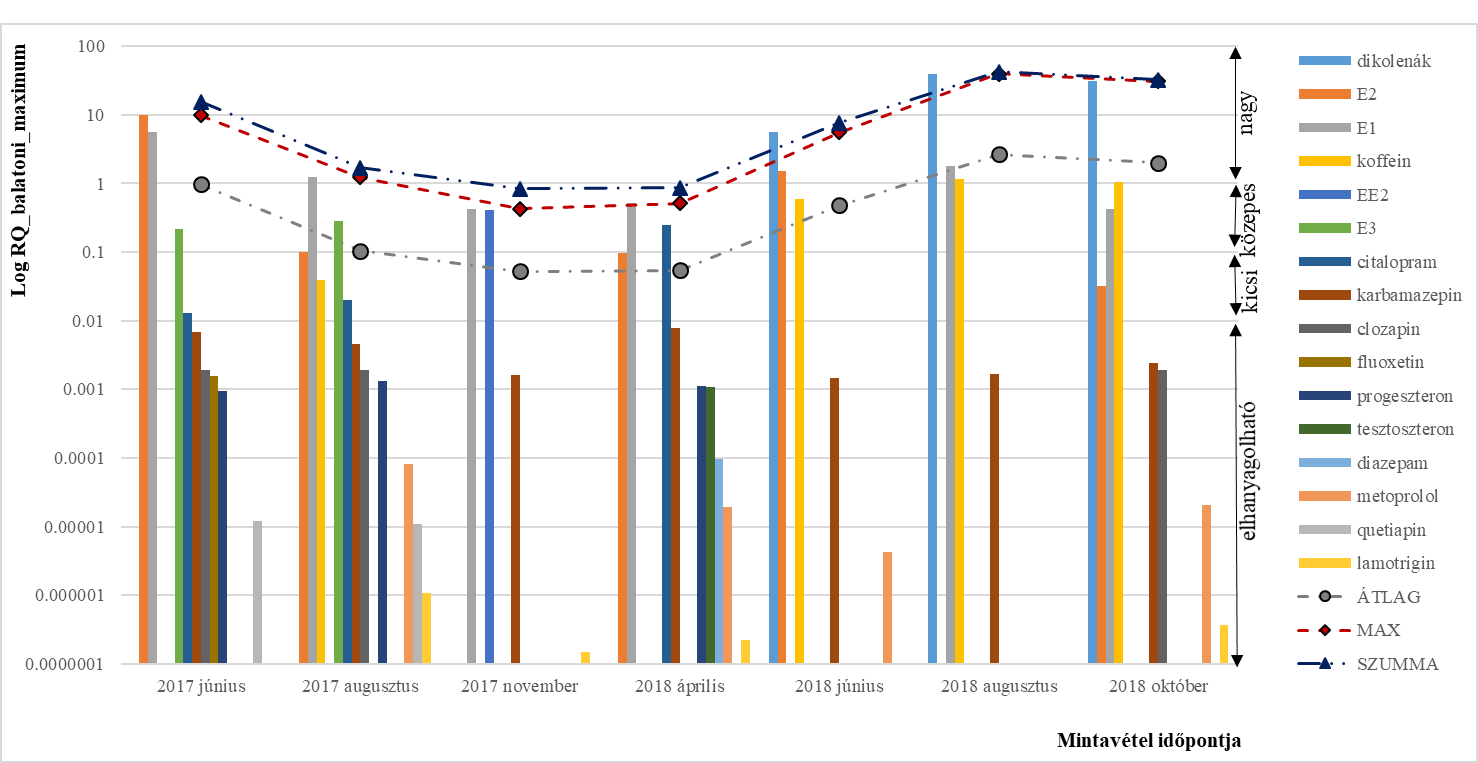
Az átlagolt, maximalizált és összegzett RQ értékek időszakos ingadozásokat mutattak a mintavételi időszakban (szezonalítás). Azonban az ábrát alaposan megfigyelve az is észrevehető, hogy a kapott eredmény 8 hatóanyag alkalmanként kiugró RQ eredményének köszönhető (csökkenő sorrendben): diklofenák, E2 (ösztradiol), E1 (ösztron), koffein, EE2 (etinilösztadiol), E3 (ösztriol) és citalopram. Ezen vegyületek voltak azok, amelyek a teljes mérési időszak alatt legalább egy alkalommal egy mintavételi helyen elérték a közepes vagy nagy kockázati besorolást.
Az egyes hatóanyagok környezeti kockázatának ismeretében joggal merül fel a kérdés, hogy milyen, a vízi ökoszisztémát érintő tényleges hatások fordulhatnak elő az emberi eredetű gyógyszerhatóanyagok által történő szennyezések során. Például, halak esetében számos közlemény olvasható arról, hogy a különböző hormonok és hormonszármazékok környezetileg releváns (~1-50) ng/L-es koncentrációban képesek lehetnek az egyedek szaporodási képességét, a spermiumok mozgékonyságát, az ivadékok túlélési képességét, a kialakuló nemet és eleve a fejlődés során zajló molekuláris folyamatokat befolyásolni egy-egy krónikus vizsgálat során. A tihanyi NAP kutatócsoport egy korábbi munkájában a progesztogén hormonok koktél hatását is vizsgálta már bodorkában (Maasz et al. 2017) és nagy mocsári csigában (Zrinyi et al., 2017) egyaránt. Megfigyelhető volt, hogy a krónikus kezelések következtében számos élettani folyamat módosult, amely hosszabb távon szélsőséges esetben akár az adott faj eltűnését is eredményezheti egy adott élőhelyről. Ismeretes, hogy ha az ökoszisztéma érzékenyebb elemeit a hatóanyag szennyezések hosszasan (akár generációkat átívelően) érik, és ez érinti pl. a szaporodást, az egyedszámuk az idő előrehaladtával lecsökken, a táplálékláncban betöltött szerepük háttérbe szorul, így az egész ökoszisztémára kiterjedő hatások figyelhetők meg.

A Balaton esetében az esetlegesen környezeti kockázatot jelentő hatóanyagok nemzetközi viszonylatban való elhelyezése alapján azt mondhatjuk, hogy a vízminőség a szerves mikroszennyezők tekintetében az európai átlagnak megfelelő. Hasonló szennyezési koncentrációk, megjelenési gyakoriságok és környezeti kockázatok jellemzik Európa más országainak felszíni vizeit is. Kétség kívül a legjobb megoldás a gyógyszerhatóanyagok természetes vizekbe való bejutásának megakadályozása lenne, azonban míg ez nem történik meg, nagy szükség van a gyógyszerhatóanyagok kiterjesztett ökotoxikológiai tesztelésére a környezeti kockázatbecslési eredmények pontosításához. Mindemellett a környezeti kockázatbecslés módszereinek finomítása és egységesítése is elvárt cél a jövőben.
Kapcsolódó korábbi munkáink: